Степень окисления элемента
Степень окисления химического элемента – величина, которая показывает как электроны распределяют между собой атомы, то есть каким образом происходит окислительно-восстановительная реакция. Тема простая, но иногда она может вызвать затруднения при решении химических задач или уравнений.
Степень окисления – что это
Атомы любой молекулы взаимодействуют между собой. При этом они отдают или притягивают электроны. Таким образом формируются общие электронные пары. В подобной паре атом, у которого электроотрицательность выше, способны притягивать к себе электроны, приобретая отрицательный заряд. И наоборот, атом, у которого электроотрицательность ниже, отдает свои электроны, приобретая положительный заряд.
Понятие степени окисления показывает условный заряд. Его после перемещения электронов предположительно получит атом. Чтобы определить степень окисления, используют предположение о том, что все свободные электроны перемещаются между атомами, образуя при этом ионные связи.
Почему речь идет об условном заряде? Дело в том, что реально он может оказаться совсем другим, а сформированные в соединении химические связи не всегда бывают ионные. Но предположение, что все состоит именно так, делается для того упростить проводимые расчеты. Это необходимо для составления классификаций и формул.
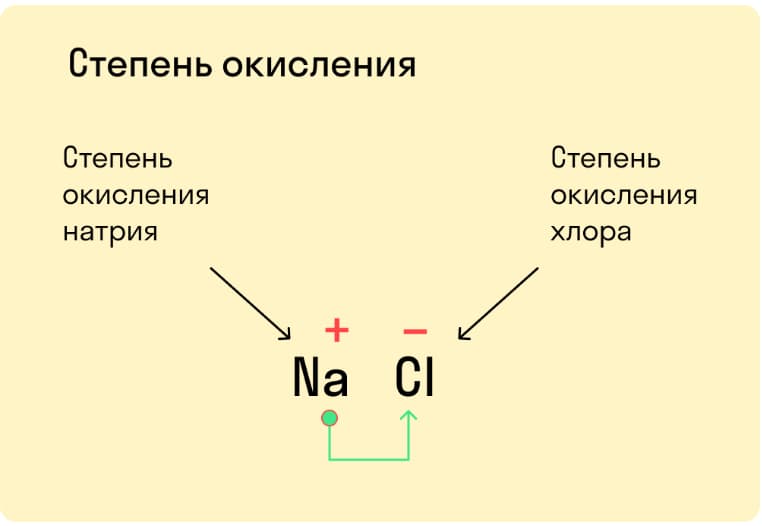
На данном этапе важно запомнить следующее:
- Степень окисления равняется тому количеству электронов, которое совершило переход между атомами.
- Атом, у которого электроотрицательность выше, притягивает к себе электроны. Его степень окисления отрицательная.
- Атом, у которого электроотрицательность ниже, отдает свои электроны. Его степень окисления положительная.
- У простых веществ (Cl2O2 и т.п.) степень окисления нулевая. У них не происходит смещения электронов.
Как рассчитать степень окисления
Для определения степени окисления химического элемента используют его электроотрицательность. Это значение указано в таблице Менделеева или на шкале относительной электроотрицательности. Чтобы понять, какой из элементов, участвующих в химической реакции притягивает, а какой отдает электрон, необходимо сравнить их показатели электроотрицаемости. Если это значение выше, то элемент притягивает к себе атомы, приобретая отрицательный заряд.
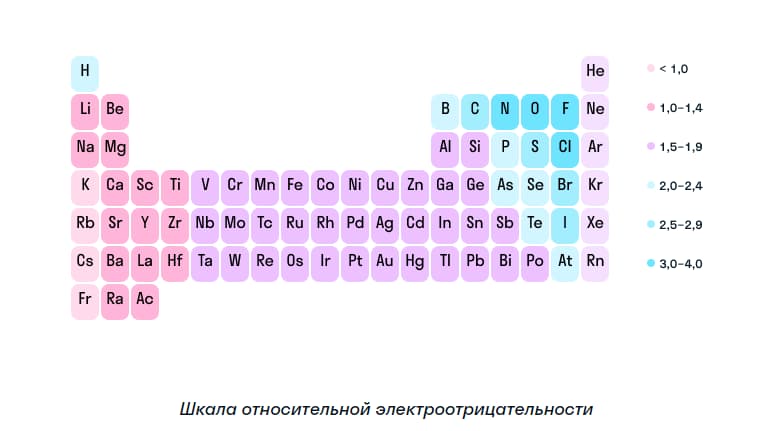
В нейтральной молекуле сумма окислительных чисел будет равна нулю. Их сумма в ионе будет равняться заряду самого иона.
Зная это правило, легко составить уравнение или рассчитать какая степень окисления у каждого химического элемента, входящего в состав соединения. Чтобы упростить расчеты, также следует запомнить некоторые закономерности:
- окислительное число водорода, входящего в состав гидрита равно -1, в любом другом веществе, окислительное число этого элемента равно +1;
- степень окисления кислорода, входящего в состав оксида равна -2, в пероксидах -1, при соединении с фтором окислительное число кислорода равняется +2;
- в соединениях неметаллов с водородом или металлом, степень окисления всегда будет отрицательной;
- степень окисления металлов всегда будет положительным значением.
Существует элементы, у которых окислительное число всегда будет постоянной величиной. Это связано с тем, что они в любом соединении будут принимать или отдавать одинаковое число электронов.

Алгоритм действий
Основные закономерности рассмотрены. Теперь можно разобраться с тем, каким образом можно определить степень окисления на конкретных примерах. Для этого используется определенный алгоритм:
- Первое, что нужно сделать, это определить, является ли представленное вещество элементарным. Если оно таковым является, то находится в химически несвязанном состоянии. Соответственно его окислительное число равняется нулю.
- У вещества Cl2S8 степень окисления равна нулю.
- Если вещество является соединением, необходимо определить, входят ли в его состав ионы. У многоатомного иона степень окисления суммарно равняется заряду. Эту сумму легко рассчитать, пользуясь таблицей растворимости. После этого необходимо составить уравнение, используя окислительные числа, которые нам известны.
- Если представленное соединение является нейтральной молекулой, то при составлении уравнения, необходимо взять во внимание, что его окислительные числа будут суммарно равняться нулю.
Как узнать степень окисления
Иногда, рассматривая соединение, нам неизвестно 2 и более окислительных чисел в нем. Исходя из правил математики, решить уравнение с двумя неизвестными не всегда возможно. Однако, такая наука, как химия предлагает свой способ решения подобного уравнения. Для этого стоит разделить химическую формулу на отдельные составляющие, у каждого из которых есть постоянный заряд.
Высшая и низшая степень окисления – как определить
Степень окисления может быть высшей или максимально положительной и низшей или максимально отрицательной. Между ними находятся окислительные числа, способные принадлежать определенному химическому элементу в разных соединениях. Если группа четная, у нее будут четные числа из рассматриваемого диапазона. Соответственно в нечетных группах числа нечетные.

Рассмотрим на примере, как определить степень окисления (высшую и низшую).
Хлор (Cl) относится к VII группе, поэтому его максимальная степень окисления равна +7. Таковым оно будет, если хлор входит в состав оксида (Cl2O7) или является частью серной кислоты (HClO4). Чтобы получить минимальную степень окисления, необходимо 7-8=-1. Такое значение будет, если хлор входит в состав хлороводорода (HCl).
Зная степень окисления химического элемента, легко понять, каким образом он будет вести себя в ходе окислительно-восстановительной реакции. Когда у элемента степень окисления высшая, в ходе реакции оно станет окислителем. Соответственно, если окислительное число низшее, то элемент будет выступать в роли восстановителя.
К примеру, серная кислота выступает в роли окислителя, так как заряд серы равен +6. В то же время заряд сернистой кислоты равен +4. В реакции она может стать как окислителем, так и восстановителем. Заряд сероводорода -2, что является его минимальной степенью окисления. Поэтому это вещество способно быть исключительно восстановителем.
Найти степень окисление в органическом соединении
В составе органических веществ присутствует углерод, имеющий множество неполярных связей. Поэтому определить у них значение окислительного числа сложнее. Если в составе вещества только 1 атом этого элемента, для расчетов используют стандартный способ.
К примеру, рассчитаем значение для метанола (H3C-OH). Окислительное число водорода +1, кислорода в таком вещества -2. Отсюда уравнение будет выглядеть следующим образом: х=(=1)*4+(+2)*1=0. Решив его, получим -2. Соответственно C-2H4+1O-2.
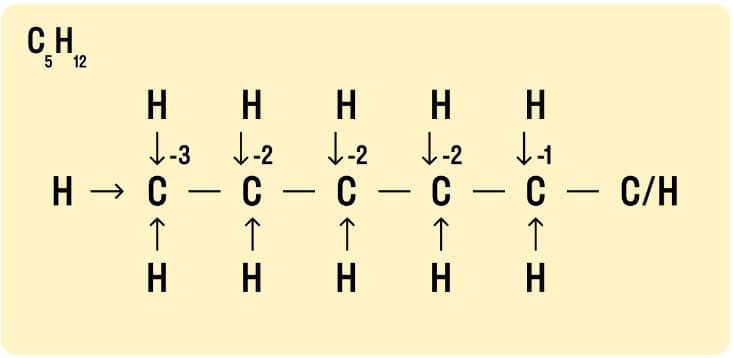
Если же в составе вещества углерода больше атомов, нужно рассмотреть структурную формулу. С ее помощью легче увидеть связи между элементами, количество электронов теряется или наоборот приобретается в ходе реакции. Это графический метод расчета окислительного числа. Как его использовать:
- Нарисовать структурную формулу вещества.
- Используя стрелки, показать химическую связь и вариант смещения атомов. При этом учитывают, что между атомами углерода связи всегда неполярные.
- Далее нужно посчитать, сколько – (минусов) и сколько + (плюсов) идут к атому. Для определения степени окисления подсчитывается сумма всех плюсов и минусов.
Валентность vs степень окисления
Такие понятия как валентность и степень окисления часто путают те, кто начал изучать химию. Численно их показатели в большинстве случаев одинаковы, но смысл у них абсолютно разный.
Валентность – это показатель, который демонстрирует, сколько связей образует атом. При этом степень окисления указывает на количество электронов, которые в ходе этих связей перемещаются.
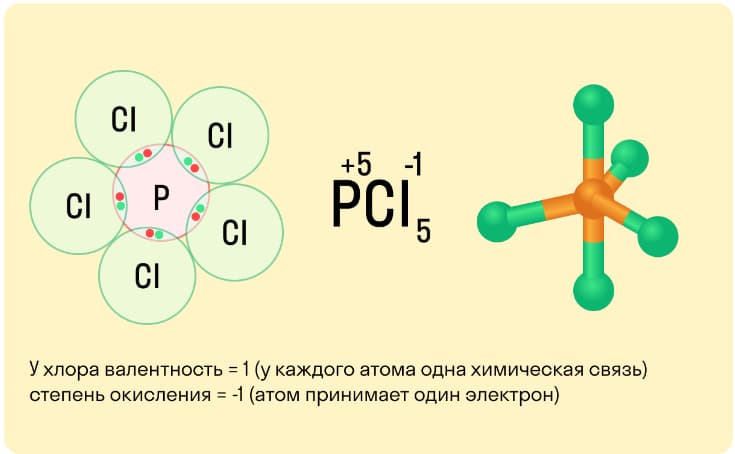
Чем отличается валентность от степени окисления:
- у валентности нет знака (+ или -), а у окислительного числа есть;
- если атом не связан с другими частицами, то его валентность нулевая, степень окисления может быть нулевой, даже если подобные связи присутствуют;
- смысл валентности всегда реален, а проводя вычисление степени окисления, делается предположение относительно ионных связей.
Разберем примеры – задачи и решения
Пример 1: необходимо определить, какой заряд имеет азот в ионе аммония.
Используя таблицу растворимости, определяем, что заряд иона аммония (NH+4) = +1. Соответственно суммарная степень окисления у него также +1. Кроме этого, мы уже упоминали, что заряд водорода везде, за исключением гидрита +1. В нашем примере у вещества сразу 4 атома водорода, поэтому 4*+1
Далее, необходимо составить формулу: х+(+1)*4=+1. Решив это уравнение, получаем х=-3.
Исходя из этого, получаем N-3H4+1.
Пример 2: необходимо определить, какая степень окисления серы в молекуле Na2SO4.
Na – щелочной металл. Его окислительное число постоянное и всегда равно +1. Как писали выше, у кислорода, который является частью оксида, заряд всегда равен -2.
Уравнение будет выглядеть следующим образом: (+1)*2+х+(-2)*4=0. Решив уравнение, получаем, что х=6. То есть Na2+1S+6O4-2.
Пример 3: необходимо определить, какую степень окисления имеет вещество (NH4)2SO4. Здесь предлагается рассмотреть это вещество, как соединение двух ионов, заряды которых нам известны: NH4+ и SO4-2.
Окислительные числа таких ионов, как водород и кислород нам известны. Соответственно, мы можем легко рассчитать значения для серы и азота.
Для начала рассмотрим ион : NH4+. Уравнение будет выглядеть следующим образом: х+(+1)*4=1. Отсюда х=-3, соответственно у азота в соединении степень окисления равняется -3.
Далее рассмотрим ион SO4-2. Уравнение будет выглядеть так: х+(-2)*4=-2. Решив его, мы получаем значение х=6. Значит степень окисления у серы здесь равна +6.
Отсюда получаем (N-3H4+1)2S+6O4-2.
FAQ
Почему степень окисления считается условным зарядом?
Это связано с тем, что для его расчета принимается во внимание предположение о смещении связи в сторону самого электроотницательного атома. Хотя на самом деле с зарядом атома показатель может не иметь ничего общего.
Чему равна низшая степень окисления?
Для этого нужно от 8 отнять порядковый номер группы, к которой принадлежит химический элемент.
Чему равно суммарное значение окислительных чисел у иона?
Сумма всегда будет равняться нулю.
Вывод
Степень окисления химического элемента – это формальный заряд атома. При этом предполагается, что электроны смещены в сторону максимально электроотрицательного элемента. При его расчете учитывают, в состав какого вещества он входит.

