Ковалентные неполярные и полярные связи
Ковалентная связь является центральным понятием в химии: большинство органических молекул построены на её основе. Её важнейшим свойством является полярность, которая обуславливает многие свойства молекул, в т.ч. растворимость, реакционную способность и характер взаимодействия с разными веществами. Поэтому неполярные и полярные ковалентные связи являются объектом пристального внимания учёных.
Ковалентная связь – что это
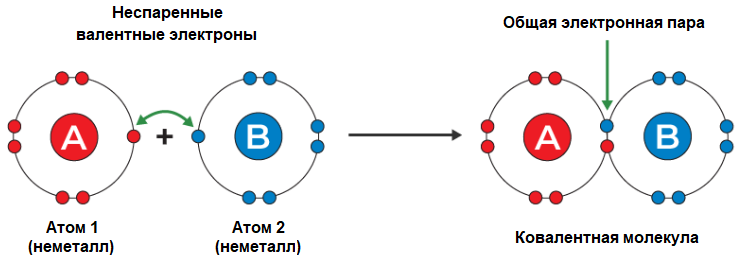
Элементы с высокой энергией ионизации не способны отдавать электроны, а элементы с низкой энергией сродства к электрону – захватывать их. Атомы таких элементов склонны к попарному обобществлению (совместному использованию) электронов, в результате которого валентная оболочка каждого приобретает октетную конфигурацию и становится устойчивой. Такую ассоциацию называют ковалентной связью.
Ковалентная связь – это химическая связь, при которой стабильная электронная конфигурация обеспечивается путём обмена электронами и образования общих электронных пар между атомами. |
Ковалентная связь формируется между одинаковыми или разными атомами неметаллов, т.е. между атомами с одинаковой или мало различающейся элетроотрицательностью – способностью смещать к себе общие электронные пары в химических соединениях.
Основные типы ковалентных связей
При образовании ковалентной связи происходит перекрывание атомных орбиталей, в зависимости от типа которого различают σ- и π-связи.
Сигма-связь (σ-связь) образуется в результате перекрытия атомных s-орбиталей «по осевой линии», при этом электронная плотность сосредоточена между ядрами связывающих атомов. Это самая прочная из всех ковалентных химических связей.
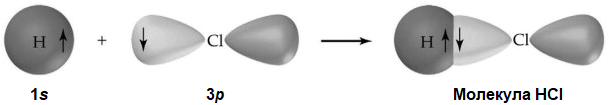
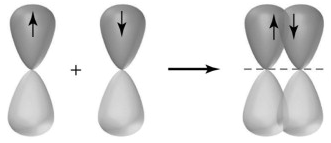
Пи-связь (π-связь) образуется вследствие перекрытия p-орбиталей латерально, т.к. по обе стороны от линии соединения атомов. Каждая из этих атомных орбиталей имеет нулевую электронную плотность в общей узловой плоскости, которая проходит через 2 связанных ядра. Пи-связь менее прочная, чем сигма-связь. Но в отличие от неё в сопряжённых системах она может быть делокализована по нескольким атомам, что приводит к повышению стабильности и приобретению ей уникальных свойств: резонансы и ароматичности.
Полярные ковалентные связи
В ковалентных связях общие электронные пары не всегда распределены равномерно между связанными атомами. Если в соединении присутствуют атомы разных элементов, то из-за различия в электроотрицательности один из них притягивает спаренные электроны сильнее. В результате на одной стороне связи происходит накопление частичного отрицательного заряда (δ-), а на другой стороне – частичного положительного заряда (δ+). Она становится полярной.
Полярная ковалентная связь – это такая химическая связь, при которой общая пара электронов неравномерно распределена между атомами, в результате чего происходит накопление отрицательного и положительного зарядов на концах молекулы. |
Например, в 2-атомной молекуле соляной кислоты (HCl) электроотрицательность атомов водорода и хлора составляет 2,2 и 3,16 единиц по шкале Полинга соответственно. Поскольку значение этой величины больше у хлора, то общая электронная пара смещается ближе к нему.
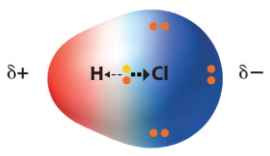
Любая ковалентная связь между атомами разных элементов является полярной, но степень её полярности варьируется в широких пределах.
Неполярные ковалентные связи
Если в молекуле атомы имеют одинаковую электроотрицательность или располагаются так, что разные электрические заряды стремятся к взаимной нейтрализации, то связующая пара электронов равноудалена от ядер этих атомов. Связь между ними неполярная.
Неполярная ковалентная связь – это такая химическая связь, при которой общая пара электронов равномерно распределена между атомами. |
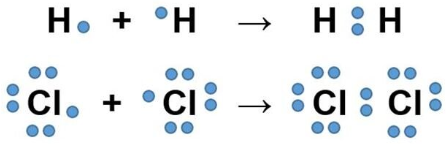
Например, в 2-атомной молекуле хлора (Cl2) присутствуют 2 атома хлора, электроотрицательность каждого из которых составляет 3,16 единиц по шкале Полинга. Поэтому электроны между ними распределены поровну.

Неполярная связь возникает между 2 одинаковыми атомами неметалла или между разными атомами.
Механизмы образования ковалентной связи
Ковалентная связь формируется путём перекрывания валентных атомных оболочек и образованием общей молекулярной оболочки. При этом возможны 2 механизма их взаимодействия:
- Обменный: при образовании связи каждый атом отдаёт на образование общей электронной пары 1 неспаренный электрон. По такому принципу создано большинство органических молекул. Например, обменный механизм формирования ковалентной связи реализуется в молекулах водорода и хлора.
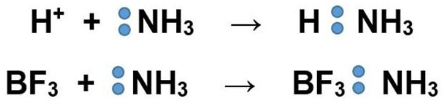
- Донорно-акцепторный заключается в том, что один из атомов (донор) отдаёт электронную пару, а второй (акцептор) – предоставляет вакантную валентную орбиталь. Например, такой механизм реализован в молекулах аммония и трифторбората аммония.
Кратность ковалентной связи
В молекулах могут образовываться одновременно несколько общих электронных пар. В этом случае рассчитывается кратность ковалентной связи.
Кратность ковалентной связи – это число общих пар электронов, образующихся между 2 атомами. |
Чем выше кратность, тем выше энергия связи и, соответственно, её прочность. В большинстве случаев между атомами органических молекул образуются от 1 до 3 общих электронных пар. Тогда говорят, что они обладают одинарными, двойными или тройными связями.
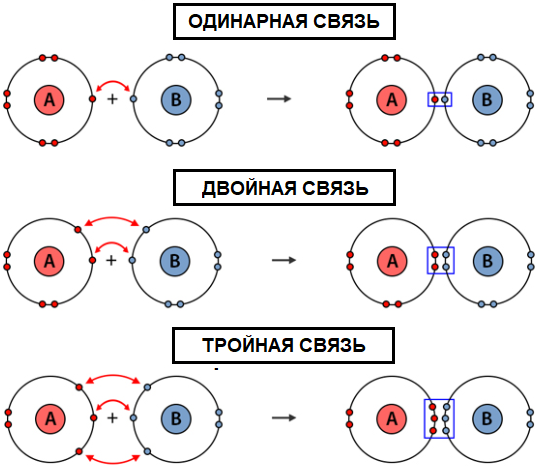
Максимально Возможная кратность ковалентной связи равна 6. Но в природе молекулы с 6 общими электронными парами встречаются редко.
Характеристики ковалентной связи
Ковалентным связям присущи специфические характеристики, которые отличают их от прочих типов химических связей. К числу уникальных свойств относятся:
- Направленность. Смысл направленности ковалентной связи заключается в том, что связываемые атомы выбирают конкретную ориентацию в пространстве. В результате образованные ими молекулы приобретают определённую форму. И поскольку есть ограниченное количество вариантов совместного использования электронов (перекрытия валентных оболочек), то существует немного способов пространственной ориентации ковалентно связанных частиц.
- Насыщаемость. Она описывается, как максимально возможное количество связей, которые образует определённый атом. Насыщаемость важна, поскольку она определяет общую структуру молекулы.
- Полярность. Неравномерное распределение электронов между атомами приводит к накоплению положительного и отрицательного заряда на концах молекул, что оказывает существенное влияние на их растворимость и реакционную способность. Кроме того, полярность обуславливает образование водородных связей, определяющих структуру и функции биологических молекул, например ДНК (дезоксирибонуклеиновой кислоты) и белков.
Разберем примеры – задачи и решение
Задача №1. Идентификация типа ковалентной связи
Из предложенного списка выберите 2 соединения, в которых присутствует неполярная ковалентная связь:
- Гидроксид натрия (NaOH).
- Вода (H2O).
- Пероксид натрия (Na2O2).
- Бромид натрия (NaBr).
- Белый фосфор (P4).
В ответе укажите простые формулы выбранных соединений.
Решение:
Неполярная ковалентная связь формируется только между 2 одинаковыми атомами. Они есть в молекулах пероксида натрия (кислородная группировка –O–O–) и белого фосфора. И хотя в молекуле воды присутствует 2 одинаковые атома водорода, они не связаны; каждый соединяется с атомом кислорода.
Ответ: Na2O2, P4.
Задача №2. Идентификация ковалентно связанных атомов
Представлены 3 электронные формулы химических соединений:
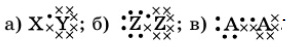
Какие из предложенных веществ соответствуют каждой формуле: NH3, H2, O2, F2, N2, HBr, HCl, Cl2? В ответе укажите простые формулы выбранных веществ.
Решение:
- В первой формуле приведены разные буквенные обозначения, следовательно, она включает атомы разных веществ. Поэтому можно вычеркнуть 5 из 8 молекул: H2, O2, F2, N2, Cl2. Далее видим, что в составе соединения присутствуют только 2 разные атома, поэтому NH3 тоже исключаем.
Остались вещества HBr и HCl. Элемент H с единственным электроном соответствует символу X. Элементы Br и Cl находятся в VII группе Периодической таблицы, и на их валентном энергетическом слое присутствует по 7 электронов; они соответствуют символу Y. Значит, оба вещества подходят.
- Во второй формуле приведены одинаковые буквенные обозначения, следовательно, она включает атомы одинаковых веществ. Поэтому можно вычеркнуть 3 из 8 молекул: NH3, HBr, HCl.
Остались вещества H2, O2, F2, N2, Cl2. Из формулы следует, что элементы содержат по 7 электронов на валентной оболочке. Этому условию соответствуют только F и Cl, т.к. они относятся к VII группе Периодической таблицы. Значит, подходят вещества F2, Cl2.
- В третьей формуле приведены одинаковые буквенные обозначения, следовательно, она включает атомы одинаковых веществ. Поэтому можно вычеркнуть 3 из 8 молекул: NH3, HBr, HCl.
Остались вещества H2, O2, F2, N2, Cl2. Из формулы следует, что элементы содержат по 5 электронов на валентной оболочке. Этому условию соответствует только N, т.к. он относится к V группе Периодической таблицы. Значит, подходит вещество N2.
FAQ
Как определить, является ли ковалентная связь полярной или неполярной?
В полярных ковалентных связях электронные пары неравномерно распределены между 2 атомами; при этом степень поляризации определяется разницей электроотрицательностей элементов в пределах от 0,4 до 1,7 единиц по Шкале Полинга. Если этот показатель ниже 0,4 единиц, то ковалентная связь является неполярной, а если выше 1,7 – ионной.
Каковы примеры неполярной ковалентной связи?
Простым примером вещества с неполярной ковалентной связью является углекислый газ. Связь между углеродом и кислородом, имеющими небольшую разницу электроотрицательностей, приводит к неполярному ковалентному взаимодействию.
Каковы примеры полярной ковалентной связи?
В молекуле воды Связь между водородом и кислородом можно классифицировать как полярно-ковалентную. В полной молекуле 2 полярные связи приводят к образованию полярной молекулы в целом.
Вывод
Среди базовых типов химических связей ковалентные наиболее распространены в природе. Они чрезвычайно прочные и в нормальных биологических условиях разрушаются только с помощью ферментов. Но чтобы глубоко понять их суть, важно исследовать свойство полярности, которая характеризуется смещением электронной плотности между связываемыми атомами. Именно полярность определяет структуру и реакционную способность веществ.
