Кислоты
Кислоты представляют один из 2 основных классов веществ наряду с основаниями. Они весьма широко распространены в природе и обеспечивают многие химические процессы, тем самым поддерживая функциональность отдельных организмов и целых экосистем. И чтобы управлять ими, важно исследовать кислоты: их классификацию и химические свойства.
Кислоты – определение и общая характеристика
Кислоты – это химические вещества, которые в ходе реакций способны или отдавать катион водорода (кислоты Брёнстеда), или принимать электронную пару с образованием ковалентной связи (кислоты Льюиса). Их определяющей характеристикой является высокая реакционная способность с основаниями.
Как правило, в быту и технике кислотами называют соединения Брёнстеда, которые при растворении в воде образуют комплексные ионы гидроксония (H3O+) в высокой концентрации.
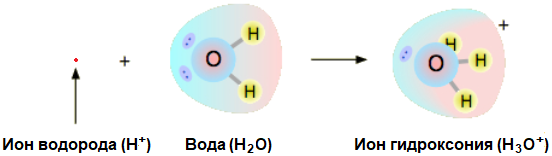
Ион гидроксония представляет собой протон водорода (кислоту), сопряженную с водой. Он является важным фактором, определяющим течение химических реакций в водных растворах; именно его концентрация считается мерой pH (показателя кислотности).
Кислоты в природе
Кислоты – это класс веществ, которые широко распространены в природе. Они присутствуют и в структурах земной коры, и в растениях, и в тканях организмов животных.
Наиболее высокие концентрации этих соединений присутствуют в растениях. Например, сок многих овощей, плодов цитрусовых содержит лимонную и яблочную кислоты, травы – щавелевую кислоту. Иногда такие вещества образуются и в организмах животных и насекомых, так, муравьи с помощью специальных брюшных желез вырабатывают муравьиную кислоту и, чувствуя опасность, выпрыскивают его на врага.
Это всего лишь пара небольших примеров. Кислоты встречаются повсеместно и без них невозможно существование органического мира.
Классификация
Существует огромное разнообразие кислот, простых и сложных. Прежде всего, их классифицируют по источнику происхождения, разделяя на 2 типа:
- Неорганические (минеральные). Кислоты этого типа получают из неорганических источников, поэтому в их составе отсутствует углерод. Большинство из них агрессивны; при растворении в воде образуют комплексные ионы гидроксония. Типичными примерами таких веществ являются фосфорная (H3PO4), соляная (HCl), серная (H2SO4) и азотная (HNO3) кислоты.
- Органические. Их получают из органических источников, например растений или животных. Наиболее распространённым классом этих веществ являются карбоновые кислоты, содержащие функциональную группу -СООН; в промышленности реже используются и более сильные сульфоновые кислоты (сульфокислоты) с группой -SO2 В качестве примеров можно привести молочную кислоту (C3H6O3) и таурин (C2H7NO3S).
Первоначально в химии господствовала «кислородная теория кислот» А. Лавуазье, согласно которой все кислоты содержат кислород. Но со временем было обнаружено, что не все подобные вещества содержат этот элемент. Поэтому их разделили на 2 класса:
- Оксикислоты (содержат кислород). Их кислотность прямо пропорциональна элеткроотрицательности центрального атома и числу атомов кислорода.
- Бескислородные. Представляют собой вещества, в которых водород соединён с неметаллическим элементом. Их кислотность зависит от сольватации исходной кислоты, энергии связи между водородом и неметаллом и энергии сродства неметалла к электрону.
В зависимости от количества атомов водорода в молекуле выделяют 2 класса кислот:
- Одноосновные, или монопротонные (содержат 1 катион водорода). Поскольку они обладают единственным атомом водорода, то присоединяют одну гидроксильную группу, образуя соль и воду. Примерами являются соляная (HCl), бромистоводородная (HBr), муравьиная (HCOOH) кислоты.
- Многоосновные, или полипротонные (содержат 2 и более катионов водорода). Они содержат 2 и более замещаемых атома водорода, соответственно, могут образовывать 2 и более типов солей. При растворении в воде диссоциируют ступенчато (в несколько этапов). Типичным примером такого вещества является ортофосфорная кислота (H3PO4).
Концентрация ионов водорода, образующаяся при растворении кислоты в воде, влияет на её силу. И чем больше количество H+ в растворе, тем сильнее кислота. В зависимости от этого параметра вещества подобного типа разделяют на 2 класса:
- Сильные. Такие кислоты полностью или почти полностью диссоциируют в воде. Например, азотная кислота образует ион водорода и нитрат-ион:
HNO3 = H+ + NO3-
- Слабые. Эти кислоты не диссоциируют или незначительно диссоциируют в воде. Например, ортофосфорная кислота распадается в 3 этапа:
H3PO4 ⇄ H+ + H2PO4-
H2PO4- ⇄ H+ + HPO42-
HPO42- ⇄ H+ + PO43-
На второй ступени диссоциация происходит значительно слабее, на третьей – почти не происходит при обычных условиях.
Физические свойства кислот
Пищевые кислоты обычно идентифицируют по их характерному кислому или терпкому вкусу. Однако большинство таких соединений (в особенности неорганических) при проглатывании опасно, т.к. разрушает ткани организма. А при соприкосновении с ними высок риск получения ожога.
Но кислоты определяются и по ряду иных физических характеристик, например:
- они могут находиться в твёрдом или жидком состоянии;
- кислоты в жидкой форме обычно бесцветные (реже желтоватые), в твёрдой – белые;
- многие летучие кислоты в концентрированном виде имеют резкий запах;
- хорошо растворяются в воде (но есть исключения, например, борная или кремниевая кислоты).
Химические свойства кислот
Общим свойством всех кислот является способность изменять цвет индикаторов:
- лакмуса – с синего на красный;
- метилового оранжевого – с оранжево-жёлтого на розовый;
- фенолфталеина – с розового на бесцветный.
Кислоты являются электролитами (проводниками электричества) и обладают высокой коррозионной активностью – разрушают металлы.
К основным химическим свойствам кислот также относятся:
- выделение ионов H+ при растворении в воде;
- выделение газообразного водорода при взаимодействии с активными металлами;
- утрата кислотных характеристик при взаимодействии с основаниями; при соединении равных количеств реагентов происходит реакция нейтрализации с образованием соли и воды.
Применение кислот
Кислоты широко применяются в различных отраслях промышленности, в медицине и быту. И некоторые из них хорошо знакомы нам.
Кислота | Область применения |
В промышленности | |
Серная кислота, H2SO4 | Производство аккумуляторной кислоты, красителей, а также солей и удобрений. Применение в системе очистки нефтепродуктов. |
Азотная кислота, HNO3 | Производство взрывчатых веществ, а также разных удобрений для нужд сельского хозяйства. |
В пищевой промышленности | |
Уксусная кислота, C2H4O2 | Производство приправ: уксуса, майонеза, горчицы и пр. Используется в качестве консерванта. |
Угольная кислота, H2CO3 | Газирование напитков. |
В медицине | |
Соляная кислота, HCl | Производство лекарственных препаратов, предназначенных для восстановления кислотности желудочного сока. |
Ацетилсалициловая кислота, C9H8O4 | Производство лекарственных препаратов, в частности, аспирина. |
В бытовой сфере | |
Ортофосфорная кислота, H3PO4 | Производство моющих средств. |
Способы получения кислот
Существует много способов производства кислот, которые предпочитаются в зависимости от того, какое вещество нужно получить. Как правило, используют следующие реакции:
- Взаимодействие между кислыми оксидами и водой, в ходе которой образуются кислые растворы. Так, включая в реакцию серный ангидрид, получаем серную кислоту:
SO3 + H2O → H2SO4
- Растворение в воде газообразных соединений неметаллов и водорода. Например, при растворении серы и водорода при высокой температуре образуется сероводородная кислота:
H2 + S → H2S
- Вытеснение из соли более летучей кислоты менее летучей кислотой. Так из натрия хлористого серная кислота вытесняет хлороводород:
2NaCl + H2SO4 = 2HCl + Na2SO4;
- Электролиз (пропускание электрического тока) водных солевых растворов, при котором вещества распадаются, образуя кислоты. Например, растворённый в воде сульфат меди (II) диссоциирует на свободный ион меди и кислотный остаток SO4, вода – на ионы водорода и гидроксида; при взаимодействии H+ и SO42- образуется серная кислота:
2CuSO4 + 2H2O = 2Cu +O2 + 2H2SO4
Реакция «кислота + металл»
Некоторые металлы при взаимодействии с кислотами вытесняют из них водород – происходит реакция замещения. Её продуктами являются соль и газ (газообразный водород), например:
Zn + H2SO4 → ZnSO4 + H2
Zn + 2HCl → ZnCl2 + H2
Однако с кислотами реагируют не все металлы: только те, которые расположены слева от водорода в ряду активности металлов. И чем дальше от H2 находится элемент, тем он менее активен.

Реакция «кислота + основание»
При взаимодействии кислоты с основанием (амфотерным гидроксидом) образуются соль и вода. Эта реакция называется реакцией нейтрализации, поскольку она приводит к утрате характерных свойств обоих реагентов. В качестве примера можно показать взаимодействие между серной кислотой и гидроксидом натрия:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Реакция «кислота + соль»
Между кислотами и солями также возможны реакции. Как правило, более сильная кислота реагирует с солью более слабой кислоты и вытесняет её. Продуктами реакции являются соль и кислота, например:
H2SO4 + BaCl2 = BaSO4 + 2HCl
FAQ
Каковы сходства кислот и оснований?
Хотя кислоты и основания – это химически противоположные классы веществ, они всё же обладают некоторыми сходствами. Прежде всего, оба соединения имеют высокую антикоррозионную активность и способны вызвать ожог при попадании на кожу или слизистую оболочку. И кислоты, и основания обычно растворимы в воде и проводят электричество (являются электролитами).
Что такое показатель кислотности (pH)?
Показатель кислотности, или водородный показатель, или pH – это важная величина в химии, которая выражает кислотно-основные свойства растворов. Она указывает на активность ионов водорода и измеряется по шкале от 1 до 14: pH < 7 соответствует кислотному раствору.
Измерение водородного показателя критически важно в разных отраслях промышленности, включая медицину, фармацевтику, агрохимию, транспорт и пр. Он оказывает непосредственное влияние на течение различных химических, биологических и экологических процессов.
Вывод
Кислоты – один из важнейших классов веществ, который рассматривается в рамках школьной программы по химии в 8 классе. Понимание свойств и умение использовать эти соединения обеспечивают прочный фундамент для освоения всех последующих тем.

