Ионная связь
Ионная связь относится к числу наиболее важных химических связей. Она возникает между атомами металлов и неметаллов и обусловлена притяжением противоположно заряженных ионов. Её особенностью является высокая прочность, которая определяет уникальные характеристики ионных соединений.
Химические связи
Химическая связь – это одна из фундаментальных основ химии, которая помогает предсказывать поведение вещества в разных средах. Независимо от того, является соединение органическим или неорганическим, реакции с его участием протекают с образованием или разрывом межатомных связей.
Химическая связь – это любое взаимодействие между атомами, которое приводит к их объединению и образованию относительно устойчивой молекулы или кристалла. Она обусловлена взаимодействием между заряженными частицами (ядрами и электронами). |
Согласно современным научным представлениям, химическая связь подчинена законам квантовой механики. Когда атомы сближаются, между ними возникает электрическое притяжение; они стремятся принять такое расположение в пространстве, при котором их общая энергия имеет минимальную величину из спектра возможных вариантов. И если общая энергия группы атомов окажется ниже суммы энергий отдельно взятых атомов, то частицы объединятся в молекулу (или кристалл). При этом разница энергий равна энергии связи.
Существует несколько разновидностей химических связей, однако в биологии наиболее важными считаются 2 из них: ионные и ковалентные.
Ионные связи – определение
Ионная (электровалентная) связь – это химическая связь, обусловленная электростатическим притяжением противоположно заряженных ионов.
Ионная связь образуется, когда валентные электроны переносится от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. Это происходит вследствие того, что сильная частица стремится приобрести такую конфигурацию внешней оболочки, которая соответствует правилу октета. Нейтральный атом, теряющий электрон, становится положительно заряженным ионом (катионом), а приобретающий электрон – отрицательно заряженным ионом (анионом).
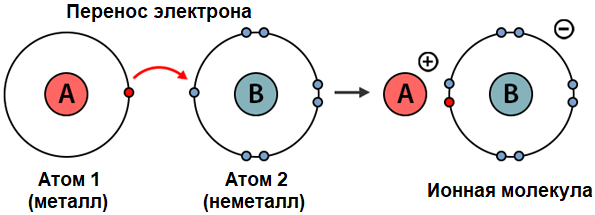
Ионную химическую связь принято рассматривать как крайний случай полярной ковалентной связи. Она формируется, когда разница показателей электроотрицательности взаимодействующих атомов превышает 1,7 единиц по шкале Полинга. При этом важно отметить, что при её возникновении полной передачи электрона не происходит. Это связано с тем, что минимально возможная электроотрицательность не равна нулю, и атом металла частично сохраняет влияние на связывающий электрон.
Вещества с ионными связями
Ионная связь возникает между атомами металлов и неметаллов. При этом образовавшиеся соединения в обычных условиях представляют собой не дискретные молекулы, а ионные кристаллы – обширные трёхмерные массивы, состоящие из чередующихся катионов и анионов.
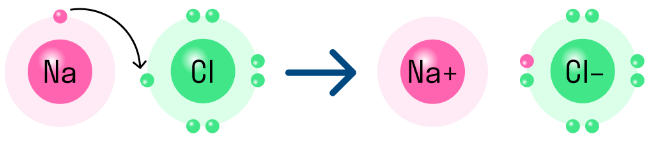
Примером соединения с ионной связью является NaCl (хлористый натрий) – натриевая соль соляной кислоты. Это вещество возникает в результате переноса электронов от металлического иона натрия к неметаллическому хлору. Образуется положительно заряженный ион Na+ и отрицательно заряженный Cl-.
В чистом виде хлористый натрий представляет собой кристаллическое вещество, обладающего гранецентрированной кубической решёткой (ГЦК). Соседние ионы располагаются на гранях куба (их 6).

Другими примерами соединений с ионными связями являются: BaO, MgCl2, Ba(OH)2 и пр.
Координационное число
Чтобы предсказать геометрию кристаллической решётки и свойства ионных соединений, в химии рассчитывают координационное число – количество атомов (ионов), которые центральный атом (ион) несёт в кристалле в качестве своих ближайших соседей.
К примеру, уже известно, что кристаллическое вещество NaCl образует гранецентрированную кубическую решётку, в которой каждый ион Na+ контактирует с шестью ионами Cl-. Иными словами, его координационное число равно 6.
Характеристики ионной связи
Ионная связь имеет существенные отличия от прочих химических связей, в т.ч. ковалентной и металлической. К числу её основных характеристик относятся:
- Ненаправленность. Известно, что ковалентные связи направлены, т.к. предпочитают определенную ориентацию в пространстве относительно друг друга; в результате молекулы приобретают определённую форму. В отличие от них ионные связи не направлены, поскольку заряд одинаков во всех направлениях: ион окружён другими ионами со всех сторон.
- Ненасыщаемость. В химии насыщаемостью называют способность атомов образовывать определённое ограниченное число химических связей пропорционально числу свободных неспаренных электронов. Но при образовании ионных соединений не происходит обобществления зарядов, вместо этого их противоположно заряженные ионы взаимно притягиваются. Поэтому не имеет смысла говорить о насыщаемости ионных связей.
- Отсутствие кратности. В химии кратность соответствует числу электронных пар, занимающих область между 2 связанными атомами на связывающих орбиталях. И поскольку ионные соединения формируются за счёт электростатического притяжения между ионами, то они не имеют кратности.
Физические свойства ионных соединений
Главной характеристикой ионной связи является высокая прочность. Эта особенность наряду с кристаллическим строением ионных веществ определяет их физические свойства:
- Высокую твёрдость, хрупкость. Поскольку ионные связи являются высокопрочными, то чтобы спровоцировать смещение одного слоя ионов относительно соседнего, нужно приложить большую механическую силу, например, ударить молотком по кристаллу. Но в этот момент одноимённо заряженные ионы сближаются, и нарастающие силы отталкивания между ними разрушают вещество.
- Тугоплавкость. Из-за одновременного возникновения множественных сил притяжения между катионами и анионами ионные кристаллические решетки очень прочны. Поэтому процесс плавления ионных соединений требует приложения большого количества энергии, чтобы разорвать все химические связи. Например, хлористый натрий имеет температуру плавления около +800°C.
- Растворимость в воде. Ионные соединения растворяются в полярных растворителях, и особенно хорошо в воде. Это происходит, когда положительный катион ионного твёрдого вещества притягивается к отрицательному концу молекулы воды (кислороду), а отрицательный анион – к положительному концу (водороду).
- Электропроводность. Ионные соединения проводят электрический ток при плавлении или растворении в воде, т.к. в этом случае заряженные ионы становятся подвижными.
Как определить ионную связь
Чтобы прогнозировать поведение вещества, важно понимать, какой тип химической связи оно имеет. Есть несколько способов идентифицировать ионное соединение:
- Изучить состав вещества. Ионные связи образуются только между атомами металлов и неметаллов. При этом в простейшей химической формуле впереди стоит символ металла, а за ним следует символ неметалла. Например, NaCl (хлористый натрий) является типичным ионным соединением, т.к. натрий относится к группе щелочных неметаллов, а хлор – к группе галогенов.
- Сравнить электроотрицательность атомов, которые присутствуют в составе соединения. Показатели определяют по шкале Полинга: если разница между ними составляет более 1,7 единиц, то соединение является ионным.
Ковалентная связь vs ионная связь
Характеристика | Тип химической связи | |
Ковалентная | Ионная | |
Условия формирования | Возникает между атомами с одинаковой или незначительно отличающейся электроотрицательностью, обычно между атомами неметаллов | Возникает между атомами, разница электроотрицательностей которых превышает 1,7 по шкале Полинга, между металлами и неметаллами |
Механизм формирования | Связанные атомы имеют общие электроны на валентной оболочке | Происходит перенос электрона от одного атома к другому |
Природа сил взаимодействия | Электростатическая: общая электронная пара притягивается ядрами обоих атомов | Электростатическая: между ионами с противоположными зарядами возникает кулоновское притяжение |
Состояние вещества | Твёрдое, жидкое или газообразное | Только твёрдое |
Имеет кратность, направленность, насыщенность | Не имеет кратности, направленности, насыщенности | |
FAQ
Могут ли возникать ионные связи между атомами металлов?
Основным условием образования ионной связи является потеря электронов одним из взаимодействующих атомов и его приобретение другим. Но не существует металла, который мог бы принимать электроны. Поэтому ионная связь между 2 атомами металла невозможна.
Что такое ион?
Ион – это любой атом или группа атомов, несущий один или несколько положительных или отрицательных электрических зарядов. Положительно заряженный ион называется катионом, отрицательно заряженный ион – анионом. Обычно они образуются в результате присоединения электронов к нейтральным атомам или молекулам или удаления электронов из них.
Вывод
Соединения с ионной связью обладают прочными межмолекулярными связями, которые делают их устойчивыми. Они обладают уникальными свойствами, включая высокие температуры плавления и кипения, электропроводимость при растворении, растворимость в воде. Всё это обуславливает широкий спектр применений ионных соединений в разных областях человеческой деятельности.

