Химические уравнения
Химическое уравнение – условное обозначение превращения одних веществ в другие, в результате химической реакции. Для этого используют химические формулы веществ и математические знаки. Также в химических уравнениях присутствуют индексы и коэффициенты. Индексами называют количество атомов в составе молекулы, а коэффициентом – число атомов или молекул.
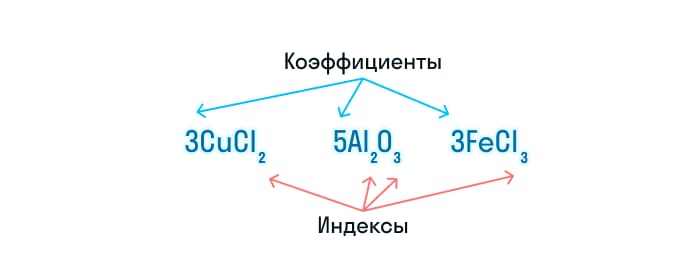
Химическое уравнение – что это
При взаимодействии нескольких химических веществ друг с другом, происходит разрушение связей их атомов. При этом образуются новые. Так происходит разрушение одних и формирование других химических веществ.
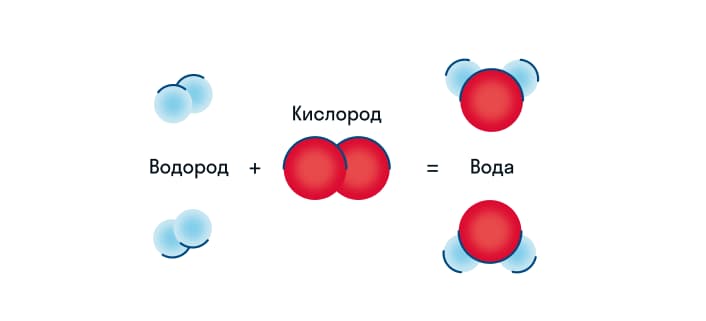
К примеру, так выглядит процесс объединения кислорода с водородом, в результате которого получается вода. Но сложные химические процессы таким способом изобразить не получится. Поэтому используют химические уравнения.
Вступающие в химическую реакцию вещества называют исходными или реагентами. Образующиеся в результате такого взаимодействия вещества, имеют название продукты реакции.

В данном случае кислород и водород выступают в качестве реагентов, а вода становится продуктом реакции.
В процессе формирования новых веществ, происходит перегруппировка атомов веществ, которые вступили в реакцию. Исчезнуть они не могут, поэтому их число в правой и левой части уравнение будет одинаковым. Именно об этом свидетельствует закон сохранения массы вещества: «Масса веществ, которые вступили в химическую реакцию, равняется массе образованных в ее процессе веществ».
Какие бывают химические реакции
Химические реакции бывают разные. Самые распространенные из них:
- Соединение. В ходе реакции из двух или более реагентов образуется один новый продукт. К примеру, при соединении негашеной извести и воды, формируется гашеная известь.
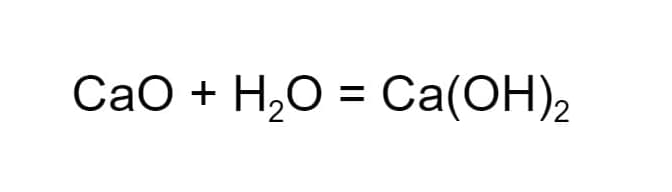
- Разложение. Этот процесс обратный соединению. В ходе реакции одно вещество распадается и в результате образуется несколько более простых. К примеру, при нагревании известняк распадается на негашеную известь и углекислый газ. При этом углекислый газ улетучивается, что в химической формуле обозначается стрелкой вверх.
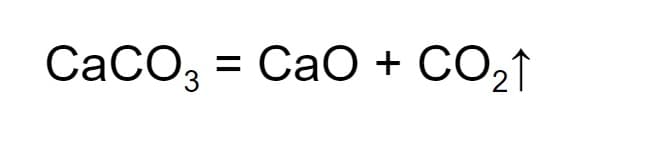
- Замещение. Вступая в реакцию, простое и сложное вещество замещают атомы друг друга, в результате чего образуются новые вещества. К примеру, при взаимодействии цинка с хлороводородом, образуется хлорид цинка и молекула водорода, которая улетучивается.
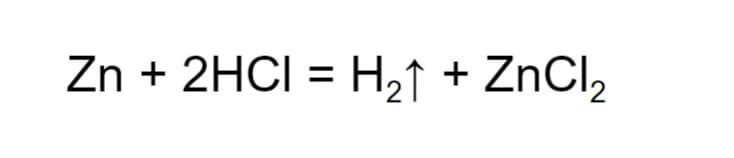
- Обмена. В ходе реакции 2 сложных вещества обмениваются частями. При этом формируются новые сложные химические вещества. К примеру, вступая в реакцию хлорид кальция, обменивается атомами с карбонатом натрия. В результате образуется карбонат кальция, который выпадает в осадок и хлорид натрия.
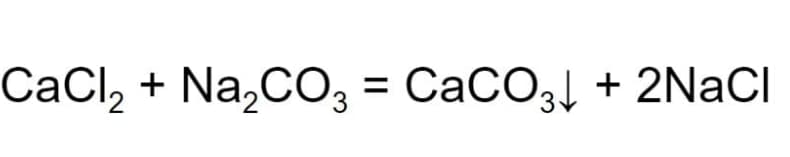
Также химические реакции могут различаться по изменению степени окисления:
- окислительно-восстановительные – те реакции, в ходе которых происходит изменение степени окисления элементов;
- реакции, в ходе которых степень окисления остается неизменной.
В окислительно-восстановительных реакциях всегда присутствуют:
- окислитель – вещество, принимающее в ходе реакции электроны, что приводит к снижению степени его окисления;
- восстановитель – вещество, отдающее электроны, что приводит к повышению степени его окисления.
В ходе реакции одновременно происходит процесс восстановления (принятия электронов) и окисление (передача электронов другому веществу).
Как записывать уравнение химической реакции – основной алгоритм
Многие школьники ищут онлайн сайта с ГДЗ, чтобы выполнить домашнее задание по химии. Но, оказывается, делать это не сложно, если усвоить простой алгоритм записи уравнений химических реакций. Рассмотрим его на примере реакции кислорода с магнием, в результате которого получается вещество оксид магния:
- В левой части уравнения будут находиться вещества, вступающие в химическую реакцию. Между ними ставится «+».
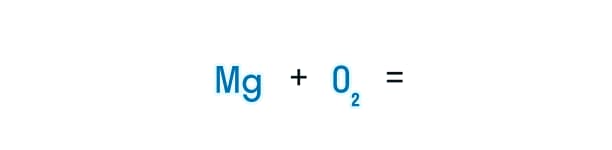
- Далее ставится знак «=», после которого будет располагаться вещество, полученное в результате химической реакции. При составлении формулы химического вещества, необходимо учитывать валентность химических элементов, которые входят в его состав.
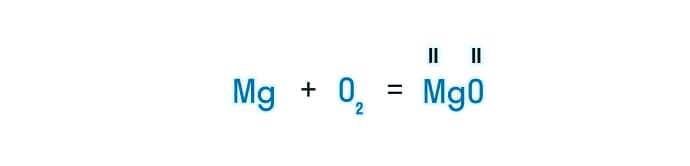
- Записывая формулу, важно помнить закон сохранения массы вещества. Это значит, что количество атомов каждого элемента в обеих частях уравнения должно быть одинаковым. Учитывая это расставляются коэффициенты. К примеру, в данном уравнении в левой части 2 атома кислорода, а в правой всего 1. Это значит, что для того, чтобы уравнять запись, нужно найти наименьшее общее кратное. Для нашего уравнения – это 2. Теперь полученное значение нужно разделить на количество атомов кислорода и записать ответ в виде коэффициента.
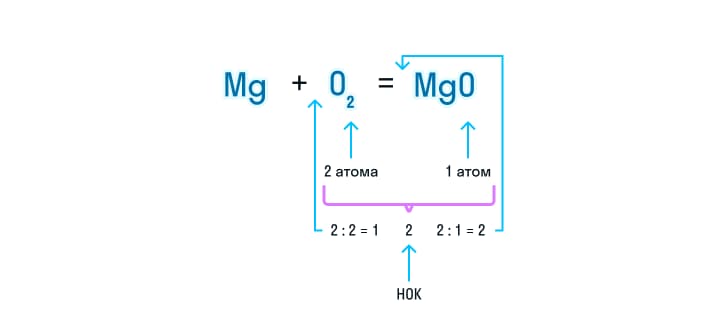
- Далее следует проверить, сколько атомов магния находится в обеих частях уравнения. Если перед формулой есть коэффициент, то чтобы посчитать, сколько здесь атомов, индекс элемента умножают на коэффициент.
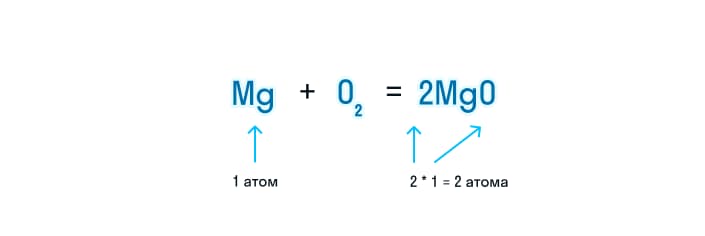
- Чтобы уравнять количество атомов этого вещества, находим наименьшее общее кратное и делим полученное число на количество атомов в разных частях уравнения. Итоговое число и будет коэффициентом.
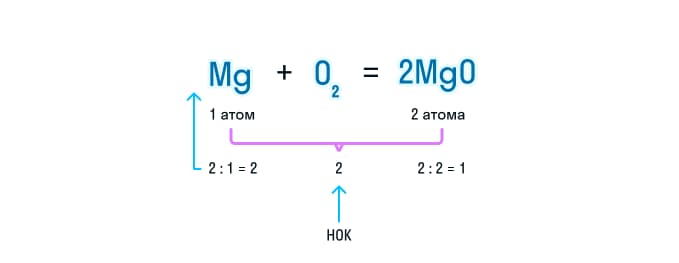
- В итоге у нас получается уравнение, где в обеих частях будет по 2 атома кислорода и магния.
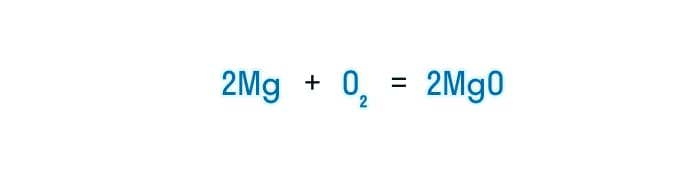
FAQ
В чем суть химической реакции?
Суть любой химической реакции заключается в том, что в ходе нее все связи между веществами, участвующими в процессе разрываются. При этом происходит перегруппировка атомов с формированием новых веществ. Таким образом, образуются продукты реакции.
От чего зависит интенсивность химического взаимодействия веществ в процессе химической реакции?
Интенсивность зависит от химических свойств веществ вступающих в реакцию и условий, в которых она проходит.
Почему справедлив закон сохранения массы вещества?
Этот закон можно объяснить тем, что в результате химической реакции количество атомов всегда остается неизменным. Они просто перегруппируются.
Что такое химическое равновесие?
Химическим равновесием называют состояние, когда скорости прямой и обратной реакции одинаковые. На него могут оказывать влияние температура, давление и концентрация исходных веществ.
Вывод
Химическое уравнение – это способ визуального изображения химической реакции. Для этого используют формулы химических веществ и математические знаки «+», «-» и «=». В результате можно наглядно увидеть, что произошло с веществами, вступившими в химическую реакцию.
