Химические свойства солей
Что такое соли?
Соли - это класс химических соединений, образованных в результате реакции нейтрализации между кислотами и основаниями. Они состоят из положительных и отрицательных ионов, которые образуют ионную решетку.
Виды солей
Неорганические соли: Это соли, состоящие из металлических и неметаллических элементов. Например, хлорид натрия (NaCl), сульфат меди (CuSO4) и нитрат калия (KNO3).
Органические соли: Это соли, в которых один из компонентов является органическим соединением. Например, ацетат натрия (CH3COONa) или лимонная кислота (C6H8O7).
Кислотные соли: Это соли, образованные из кислот и оснований, в которых анион происходит от кислоты, а катион - от основания. Например, сульфат натрия (Na2SO4) или нитрат кальция (Ca(NO3)2).
Основные соли: Это соли, образованные из кислот и оснований, в которых катион происходит от кислоты, а анион - от основания. Например, гидроксид натрия (NaOH) или гидроксид кальция (Ca(OH)2).
Соли имеют множество применений в различных областях, включая пищевую промышленность, медицину, химическую промышленность, сельское хозяйство и технологические процессы. Они также играют ключевую роль в жизнедеятельности организмов, включая человека, где служат важными источниками электролитов и минеральных веществ.
Получение солей
Получение солей в ходе химических реакций может происходить различными способами. Вот несколько примеров:
Нейтрализация:
- Это один из самых распространенных способов получения солей. При нейтрализации кислоты и основания образуется соль и вода. Например, реакция между соляной кислотой (HCl) и гидроксидом натрия (NaOH) приводит к образованию хлорида натрия (NaCl) и воды:
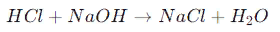
Окислительно-восстановительные реакции:
- Соли также могут быть получены в результате окислительно-восстановительных реакций. Например, окисление меди (Cu) кислородом в кислотной среде приводит к образованию сульфата меди (CuSO4):
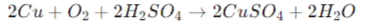
Двойная замена:
- Этот процесс включает обмен ионами между двумя соединениями, что приводит к образованию двух новых соединений. Если одно из новых соединений является нерастворимой солью, то она может выпасть в виде осадка. Например, реакция между хлоридом серебра (AgCl) и нитратом натрия (NaNO3) приводит к образованию хлорида натрия (NaCl) и нитрата серебра (AgNO3), причем AgCl выпадает в виде осадка:
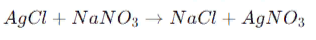
Реакции с кислородом:
- Некоторые соли могут быть получены путем реакции с кислородом. Например, реакция железа (Fe) с кислородом (O2) приводит к образованию оксида железа (Fe2O3):
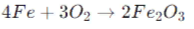
Химические свойства
Химические свойства солей в значительной степени зависят от состава и структуры конкретной соли. Однако, существуют общие химические свойства, которые можно выделить для большинства солей:
Растворимость: Многие соли растворяются в воде, образуя ионные растворы. Растворимость может варьироваться в зависимости от температуры и других условий.
Реакция с кислотами: Соли обычно реагируют с кислотами, образуя соответствующие кислотные соли и воду. Например, хлорид натрия (NaCl) реагирует с серной кислотой (H2SO4), образуя хлорид натрия (Na2SO4) и воду.
Реакция с основаниями: Соли также могут реагировать с основаниями, образуя соответствующие основные соли и воду. Например, нитрат калия (KNO3) реагирует с гидроксидом натрия (NaOH), образуя нитрат натрия (NaNO3) и воду.
Термическое разложение: Некоторые соли могут разлагаться при нагревании, особенно если они содержат анионы, нестабильные при высоких температурах. Например, карбонат кальция (CaCO3) разлагается при нагревании, образуя оксид кальция (CaO) и углекислый газ (CO2).
Окислительные и восстановительные свойства: Некоторые соли обладают окислительными или восстановительными свойствами, особенно металлические соли переходных металлов.
Комплексообразующие свойства: Некоторые соли могут образовывать комплексы с различными лигандами, что делает их полезными в аналитической и координационной химии.
Химические свойства солей являются основой многих процессов и реакций в химии и имеют широкое применение в различных областях науки и технологии.
