Электронный баланс
При составлении химических уравнений учитывается закон сохранения масс: в ходе реакции не могут исчезнуть или появиться новые атомы. Поэтому количество атомов в левой и правой части нужно уравнять. И в этом случае используется электронный баланс.
Электронный баланс: определение
Простыми словами, электронный баланс – это равенство отданных и принятых электронов в ходе окислительно-восстановительной реакции. При взаимодействии реагентов степень окисления их атомов изменяется, что позволяет учесть передвижение зарядов и правильно расставить коэффициенты.
Прежде чем использовать метод электронного баланса на практике, следует выяснить, что такое окислительно-восстановительные реакции и степень окисления.
Окислительно-восстановительные реакции
К окислительно-восстановительным реакциям относятся такие химические реакции, в ходе которых между реагентами происходит перенос электронов. Этот перенос можно идентифицировать, наблюдая за изменениями степени окисления реагирующих частиц.
На схеме показано, как протекает типичная окислительно-восстановительная реакция. Если при взаимодействии реагентов A и B происходит перенос электрона от первого ко второму, то меняется и степень окисления образующихся веществ. Реагент A приобретает заряд «+1», а реагент B – «-1». В таком случае говорят, что A окисляется (теряет электроны), B – восстанавливается (приобретает электроны).
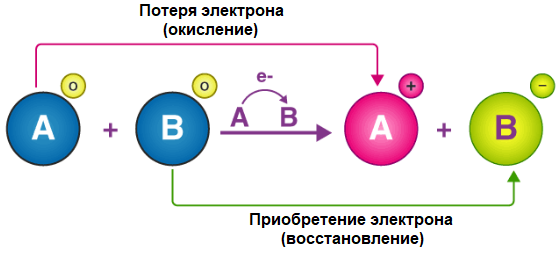
Окислительно-восстановительную реакцию можно разбить на полуреакции окисления и восстановления. При записи каждой из них следует соблюдать электронный баланс.
Практическое применение метода электронного баланса
Метод электронного баланса предполагает чёткий алгоритм действий. Чтобы правильно расставить коэффициенты в химическом уравнении, нужно:
- Указать степень окисления каждого элемента в обеих частях химического уравнения. Сразу пометить, какие из них изменились в ходе реакции.
- Записать полуреакции окисления и восстановления и составить электронный баланс: указать, сколько электронов отдано и принято в каждом случае.
- Записать коэффициенты полуреакций: в каждом случае это будет число, равное количеству отданных или принятых электронов противоположной полуреакции. Если требуется, то следует завершить расстановку недостающих коэффициентов, чтобы сбалансировать обе части уравнения.
Пример применения метода
В качестве примера приведём несложную реакцию между хлорным железом и сероводородом. Запишем исходные реагенты и конечные продукты, полученные в результате взаимодействия соли и кислотного газа. Теперь уравняем обе части с помощью метода электронного баланса:
- В ходе реакции степень окисления меняется у железа (Fe) и серы (S).
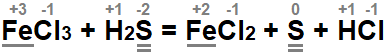
- Записываем полуреакции окисления: железо восстанавливается (приобретает 1 электрон), а сера – окисляется (теряет 2 электрона). Чтобы уравнять электроны, ставим соответствующие коэффициенты: 2 – для железа, 1 – для серы.
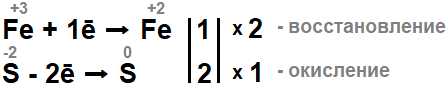
- Вводим найденные коэффициенты в уравнение (перед серой коэффициент 1 не указываем).

Соблюдая порядок расстановки, указываем остальные коэффициенты. Сначала уравниваем хлор в разных частях уравнения, затем проверяем баланс по водороду.
В результате получаем уравнение, в котором обе части уравнены. При взаимодействии 2 молекул хлорного железа и 1 молекулы сероводорода образуется 2, 1 и 2 молекулы хлористого железа, серы и соляной (хлороводородной) кислоты соответственно.
FAQ
Что такое коэффициент в химических уравнениях?
В химии коэффициентом называют число, которое ставится перед формулами реагентов и указывает на количество присутствующих молекул. Например, в формуле 3H2O коэффициент «3» находится впереди и указывает на наличие 3 молекул воды.
Каков порядок расстановки коэффициентов в химических уравнениях?
При балансировке частей химического уравнения важно соблюдать очерёдность расстановки коэффициентов. Их указывают последовательно для следующих элементов:
- металлов;
- неметаллов (кроме водорода и кислорода);
- водорода.
Чтобы убедиться в правильности расстановки коэффициентов, проверяют баланс по кислороду.
Вывод
Электронный баланс – один из основных методов расстановки коэффициентов в химических уравнениях с изменением степени окисления. Он имеет чёткий алгоритм. Следуя ему, легко составить баланс.
