Азот
Азот (N2) - это химический элемент, который является одним из основных компонентов атмосферы Земли и имеет важное значение для жизни на планете.
Вот некоторые из его основных свойств:
Физические свойства:
- Азот является безцветным, безвкусным и непахучим газом при нормальных условиях (при температуре и давлении на уровне моря).
- Он характеризуется низкой растворимостью в воде и большинстве других растворителей.
- Температура кипения азота составляет -195,8 градусов Цельсия, а температура плавления - 210 градусов Цельсия.
Химические свойства:
- Молекула азота состоит из двух атомов, которые связаны тройной ковалентной связью (N≡N).
- Азот является малоактивным химическим элементом при обычных условиях, но при высоких температурах и давлениях может образовывать различные соединения.
- Он обычно проявляет более высокую реактивность в виде оксидов азота, таких как диоксид азота (NO2) и оксид азота (NO).
Биологическая роль:
- Азот является важным элементом для жизни на Земле, поскольку входит в состав аминокислот, из которых строятся белки, и нуклеиновых кислот, составляющих генетический материал всех живых организмов.
- Формы азота, такие как аммиак и нитраты, являются необходимыми для питания растений и поддержания биологического цикла азота.
Промышленное использование:
- Азот широко используется в промышленности для создания аммиака (NH3), который является основным компонентом многих удобрений и других химических соединений.
- Он также используется в производстве азотных кислот, в технологии защитной атмосферы и в других химических процессах.
Экологические аспекты:
- Природный цикл азота играет важную роль в экосистемах, включая образование азотных соединений растениями и их обратное превращение в атмосферный азот денитрификацией.
- Избыточные азотные соединения в почве и водоемах могут вызывать экологические проблемы, такие как эутрофикация водоемов.
Эти свойства делают азот важным химическим элементом, который оказывает значительное влияние на многие аспекты живых организмов и на промышленные процессы.
Азот может существовать в различных степенях окисления, включая отрицательные, нулевую и положительные степени. Вот несколько примеров степеней окисления азота:
- Отрицательные степени окисления:
- Азот может иметь степень окисления -3 в некоторых аммониярных соединениях, например, в аммиаке (NH3), где каждый азотный атом имеет формальную степень окисления -3.
- В некоторых азидных соединениях азот также имеет степень окисления -3, например, в азиде натрия (NaN3).
- Нулевая степень окисления:
- Азот в виде молекулы N2 в атмосфере имеет нулевую степень окисления. В этой форме азот является малореактивным и химически стабильным газом.
- Положительные степени окисления:
- Азот может иметь положительные степени окисления, например, +1 в нитрозных соединениях, таких как оксид азота (NO), и +2 в нитритных соединениях, таких как нитрит натрия (NaNO2).
- Степень окисления азота также может быть +3, например, в нитратных соединениях, таких как нитрат натрия (NaNO3), и +5, например, в азотной кислоте (HNO3).
Эти различные степени окисления азота определяют его химическое поведение и способность образовывать разнообразные соединения с другими элементами.
Азот (N2) является малоактивным газом при стандартных условиях, однако он может участвовать в ряде химических реакций при достаточно высоких температурах и/или давлениях, а также под воздействием катализаторов. Вот несколько примеров химических реакций, в которых участвует азот:
- Образование оксидов азота:
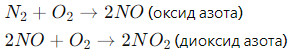
- Эти реакции могут происходить в высокотемпературных условиях, например, внутри двигателя внутреннего сгорания или в процессах сжигания топлива.
- Формирование аммиака:
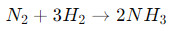
- Эта реакция известна как процесс аммиачного синтеза и широко используется в промышленности для производства аммиака, который в свою очередь используется в производстве удобрений и других химических соединений.
- Денитрификация:
- В процессе денитрификации нитраты (NO3-) в почве превращаются в азотные газы, такие как азот (N2) или оксид азота (NO).
- Этот процесс обычно осуществляется анаэробными бактериями и является важной частью биологического цикла азота в почве.
- Фиксация азота:
- Фиксация азота - это процесс превращения азота из воздуха (N2) в аммиак (NH3) или другие органические соединения азота, доступные для использования растениями.
- Этот процесс обычно осуществляется азотфиксирующими бактериями, которые способны преобразовывать азот в биологически доступные формы.
- Реакции с аммиачной водой:
- Аммиачная вода (NH3 + H2O) может реагировать с кислородом (O2) и прокислиться, образуя азотные кислоты, такие как азотная кислота (HNO3).
Эти реакции демонстрируют разнообразие химических процессов, в которых участвует азот и его соединения. Они играют важную роль в промышленности, экологии и биологии, оказывая значительное влияние на жизнь на планете.
